
PHERAstar FSX
Powerful and most sensitive HTS plate reader


借助高灵敏度检测闪光型与辉光型生物发光信号,可应用于报告基因研究、ATP 定量等多种场景。
“发光(Luminescence)” 一词由 “lumin”(拉丁语,意为 “光”)与后缀 “-escence”(用于表示过程或变化)构成,本质是一种光释放过程。根据定义,发光来源于 “冷光源”,与炽热光源(如灼热的金属、燃烧的蜡烛)产生的白炽发光(incandescence)有明确区别 ¹。发光信号可通过多种能量来源的转化产生,该过程能将不可见能量转化为可见辐射,在自然界中可作为防御机制(如某些生物的发光),在技术领域可用于屏幕 LED 显示,也可用于分析检测。本文内容聚焦发光技术在生命科学领域的应用,解释其物理原理,介绍发光酶标仪的检测方式,并列举常见的发光微孔板实验。电致发光、放射发光和热致发光与本文主题无关,故不纳入讨论范围。
发光是通过能量转化产生发光信号的过程。在生命科学领域,其应用主要依赖两种能量来源:化学能和光能,分别对应化学发光(chemiluminescence)和光致发光(photoluminescence)。其中,光致发光也是荧光(含磷光)的基础原理。
两种能量来源中的任意一种,其能量被分子吸收后,会使分子中的电子跃迁至更高能级(图 1)。由于高能级状态不稳定,电子会从激发态回落至基态。回落过程中,电子会以振动能、热能和光子的形式释放能量,而光子的释放即为发光现象 ²。
在生命科学领域,人们提及磷光或光致发光时,通常会简化表述为 “荧光”;而 “发光” 一词则通常特指化学发光。这种简化表述也体现在检测方式的差异上:荧光检测需要激发光源,而发光检测无需激发光源(图 2)。本文将遵循这一常用表述习惯,重点讨论化学发光,并在后续内容中统一以 “发光” 指代化学发光。
在化学发光反应中,底物会转化为电子激发态。处于激发态的产物或中间体,其电子回落至最低能级时会释放光子,从而产生发光现象。典型案例为鲁米诺(luminol)在过氧化氢存在下的反应(图 3):在碱性环境中,鲁米诺会以二价阴离子(Dianion)的形式与分子氧(O₂)反应,生成电子激发态的 3 - 氨基邻苯二甲酸(3-APA);随后,3 - 氨基邻苯二甲酸分子回落至正常能量状态,并释放出光。这一简单原理也是增强化学发光和生物发光的基础,因此这两者本质上也属于化学发光反应。
增强化学发光是指在化学发光反应中加入了增强剂。该技术主要以鲁米诺与过氧化氢为反应体系,但氧化反应需由辣根过氧化物酶(HRP)催化。此外,增强化学发光反应中还含有对香豆酸或 4 - 碘苯硼酸等化学物质,这些物质可增强光的产生。由于酶可催化化学反应,增强化学发光可用于酶联反应,其最主要的应用场景是免疫印迹(immunoblots):先通过分子量大小分离蛋白质,将其转移至膜上,再通过增强化学发光进行检测。膜上固定的目标蛋白质会与特异性抗体结合,随后加入偶联辣根过氧化物酶的二抗,使蛋白质 - 抗体复合物与酶连接。借助酶和增强剂的作用,仅在存在目标蛋白质的区域会产生明亮的发光信号。
基于微孔板的生物分子定量检测也采用相同原理。以发光为读数信号的酶联免疫吸附实验(ELISA)灵敏度更高,其原理正是基于增强化学发光。目标蛋白质固定在微孔板孔内,特异性抗体、偶联辣根过氧化物酶的二抗、底物与增强剂共同作用,产生的发光信号强度随蛋白质浓度的升高而增强。
生物发光存在于生命体中。该术语也涵盖两类反应:一类是利用源自生命体的酶和底物(即使在体外使用);另一类是通过基因工程改造,以获得更优特性的酶和底物反应。生物发光在生物体内具有多种生理功能:萤火虫通过发光吸引配偶;维多利亚水母(Aequorea victoria)或深海磷虾等生物,被认为通过发光抵御生物天敌;海洋费氏弧菌(Vibrio fischeri)等细菌则会在种群密度达到特定阈值时,通过群体感应(quorum sensing)产生发光信号,从而实现种群间的信息交流与行为协同。
这些生物是如何实现发光的呢?其核心机制是:酶(荧光素酶,luciferase)催化底物(荧光素,luciferin)氧化,在此过程中释放光子。不同生物会利用不同的酶和底物,且发光反应所需的辅因子、产生的发光波长也各不相同。图 4 展示了生命科学实验中常用的三种荧光素酶反应。
共振能量转移(Resonance Energy Transfer)指电子激发态的供体分子向受体荧光团转移能量的过程。该过程会激发受体荧光团,使其进而释放光子。若供体的能量来源于生物发光,则该过程被称为生物发光共振能量转移(BRET)。能量转移需满足多项条件:供体分子的发射光谱需与受体荧光团的激发光谱重叠;此外,供体与受体需处于邻近位置(通常距离为 1-10 纳米),因为能量转移效率会随距离增加而降低。因此,生物发光共振能量转移常被用于检测两种生物分子的相互作用。生物发光共振能量转移的检测输出为比值BRET,即受体荧光团的发光强度与供体的发光强度之比。BRET1、BRET2 和 NanoBRET 采用不同的酶与受体荧光团组合,具体如下表 1 所示。
表 1:BRET 类型表
|
名称 |
供体荧光素酶 |
底物 |
供体发射波长 |
受体荧光团 |
受体发射波长 |
|
BRET 1 |
Renilla |
Coelenterazine |
450-500 nm |
YFP |
515-560 nm |
|
GFP |
510-540 nm |
||||
|
BRET 2 |
Renilla |
DeepBlueC |
400-450 nm |
GFP |
500-540 nm |
|
NanoBRET |
NanoLuc |
Furimazine |
420-500 nm |
NanoBRET 618 |
550-675 nm |
|
TMR |
550-600 nm |
||||
|
AlexaFluor 633 |
600-700 nm |
||||
|
Venus |
515-575 nm |
生命科学领域的发光实验分为闪光型(flash)和辉光型(glow)两种反应类型,二者的核心区别在于信号持续时间。闪光型实验的信号持续时间最长仅几秒,通常需从反应开始到结束全程记录闪光强度。这意味着,闪光型反应需通过加入反应启动剂来启动,因此酶标仪需配备试剂注射系统,以实现反应自动启动与信号同步记录。常用的闪光型发光实验包括双荧光素酶报告基因技术(Dual-Luciferase Reporter™ technology)和 SPARCL 实验(SPARCL assays)。
与闪光型发光不同,辉光型发光可产生稳定信号,持续时间最长可达数小时。这类实验无需自动加样,可在较长时间内灵活安排检测。研究人员和试剂盒供应商通常更倾向于选择辉光型实验,因其操作更简便、检测更灵活。细胞活性检测实验 CellTiterGlo® 是辉光型发光最具代表性的应用之一。
除免疫印迹中的增强化学发光检测外,发光实验通常采用微孔板(规格涵盖 6 孔至 1536 孔)作为载体,并通过酶标仪进行定量检测。本节将介绍微孔板中发光的检测原理。
发光检测比荧光检测或吸光度检测更简便,因为它无需激发光源。这意味着既不需要光源,也不需要筛选激发波长。发光检测所需的最基础组件为:用于收集发光信号的透镜,以及用于检测信号的检测器(图 5)。若需检测生物发光共振能量转移(BRET),则需配备波长筛选工具;部分特定检测结构中,还可能需要光导纤维。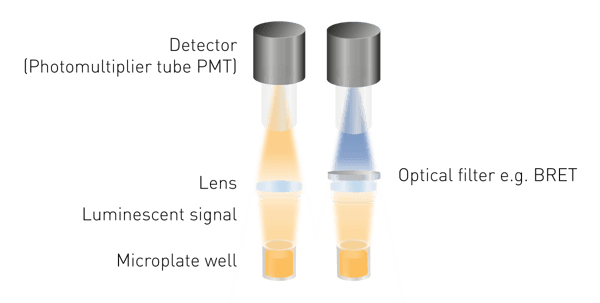
光电倍增管(PMT)是发光检测中的核心检测器。不同光电倍增管在灵敏度(可检测的最低信号)、噪声水平以及兼容的其他检测模式上存在差异。许多检测设备配备通用型光电倍增管,可同时用于发光及其他检测模式。通用型光电倍增管的优势在于占用空间小、成本低,且仍能保证较高灵敏度。通过优化光学系统,可实现极低信号的检测,例如,PHERAstar FSX 酶标仪中采用的 “自由空气光路(free-air optical path)” 与 “增强型发光光学模块(luminescence plus optic module)” 组合,便是经过优化的高性能光学系统。
专为发光检测设计的专用光电倍增管,要么噪声更低,要么采用光子计数原理。尽管两种专用光电倍增管均能检测低信号,但光子计数系统在检测高信号时存在局限性(图 6)。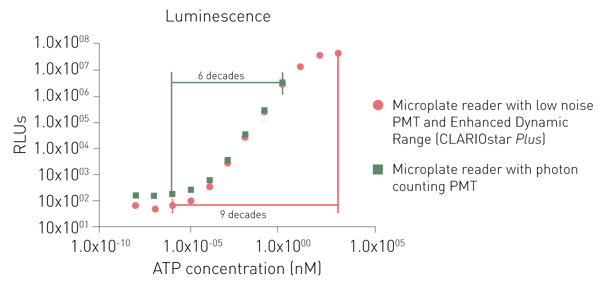
理想情况下,检测器应直接置于微孔正上方。若无法实现这一布局,则需通过光导纤维(或透镜与反光镜)将微孔中的发光信号传导至检测器。光导纤维会吸收部分发光信号,因此与 “自由空气光路” 相比,其灵敏度会有所下降。VANTAstar、CLARIOstar Plus 和 PHERAstar FSX 酶标仪均采用了自由空气光路设计。
部分应用场景为获得最佳检测结果,仅检测特定波长的信号。这一需求可通过在光路中放置光学滤光片或光栅来实现。生物发光共振能量转移(BRET)检测必须进行波长筛选,因为同一样品会产生两种信号,为区分供体和受体荧光团产生的光,需使用两种滤光片。
在筛选型发光检测和生物发光共振能量转移检测中,传统的光栅(grating-based monochromators)因灵敏度有限,应用范围较窄。这主要是由于光栅存在散射效应,且带宽较窄。然而,采用线性可变滤光片(LVF)光栅技术可满足灵敏度需求:基于LVF光栅具有类似滤光片的透光特性,带宽可达 100 纳米,能确保足够的信号到达检测器,适用于生物发光共振能量转移(BRET)等筛选型发光检测(图 7)。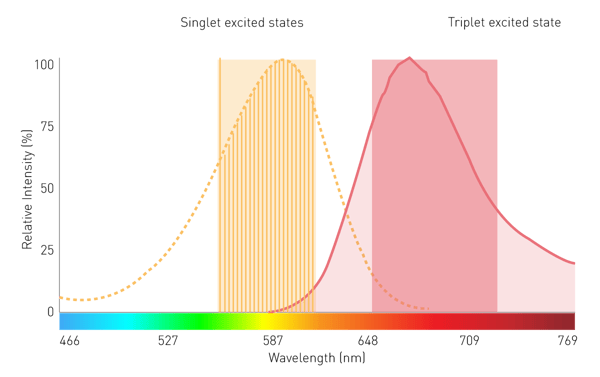
发光信号的持续时间通常为1秒或更长,这与在纳秒级时间内衰减的荧光信号有明显区别。因此,发光信号的检测通常会持续一段时间,时长一般在 0.1-1 秒之间。这段时间有多种表述方式:检测时间(measurement time)、积分时间(integration time)或检测间隔时间(measurement interval time)。具体时长需综合考虑信号强度、微孔板总检测时间等因素,在各因素间找到平衡。
酶标仪的发光检测操作相对简便,通常所需设置较少。但仍有部分与仪器相关或通用的变量,会影响检测过程与数据质量。
如前所述,积分时间(采集时间)的设定需考虑多种因素。选择积分时间时,应重点关注以下方面:
大多数实验产生的光信号足够强,仅需 0.02-0.5 秒即可检测到信号。极少情况下,为区分发光信号的差异,需将积分时间延长至几秒。
辉光型信号通常稳定,积分时间一般设为 0.1-1 秒,因此微孔板总检测时间、信号检测的时序与时长对结果影响较小。闪光型实验则不同,由于闪光型反应的信号持续时间可能就只有几秒,需完整采集从信号启动到结束的全过程。
若需了解闪光型反应的信号曲线形态及最大发射强度,需以极短的积分时间进行多次检测。例如,若某反应持续约 1 秒,可进行 50 次、每次 0.02 秒的检测,覆盖 1 秒的反应全程,从而监测信号的整个变化与衰减过程。
该因素仅对动力学检测有意义。若通过发光实验监测细胞水平或生化水平的反应,反应的时间进程会决定积分时间的设定。例如,在钙检测实验中,刺激后 20 秒内会出现反应信号,可通过 “每 2 秒检测 1 次,共检测 10 次” 的方式记录信号。若仅检测1个孔,可选择1-2秒的积分时间,以获得合适的时间分辨率;但如果需要对多个孔进行检测,且需保持相同的时间分辨率(如每 2 秒记录一次每个孔的信号),则需缩短积分时间,以确保能检测完所有孔,避免数据缺失。
由于每个孔均需设置积分时间,积分时间对微孔板总检测时间的影响较大。若每个孔的积分时间仅增加 0.2 秒,96 孔板的总检测时间会增加 20 秒,384 孔板的总检测时间会增加 1 分钟以上。因此,在高密度微孔板(384 孔或 1536 孔)检测及高通量应用(如单日需检测数千块板)中,应尽量使用短积分时间。
增益可视为一种放大系数,能使固定的动态范围窗口沿样品浓度曲线移动。低信号强度需设置高增益,而强信号则需设置低增益。通常,增益会调整至 “使预期信号最强的样品达到最大检测输出” 的水平。这样做是为了在信号最强值与最弱值之间获得尽可能宽的动态范围。因此,若实验中同时包含信号最强的阳性对照样品和未知样品,可基于阳性对照样品调整增益。
通过设置不同增益以实现大动态范围的能力,使一台仪器既能检测极低信号,也能检测强发光信号。
并非所有发光酶标仪都需要手动设置增益。是否需要设置,取决于检测器类型及增益调整过程的自动化程度。
现代发光酶标仪可自动完成增益调整,这不仅减轻了研究人员的操作负担,还能确保检测覆盖宽动态范围。例如,CLARIOstar® Plus 和 VANTAstar® 仪器搭载的 “动态范围扩展(Enhanced Dynamic Range)技术”,便具备自动增益调整功能。
白色微孔板最适合发光检测,因为它能反射发光信号(而非吸收信号)。关于微孔板选择的更多细节,可参考《微孔板:实际应用价值》("The microplate: utility in practice")。
需特别注意:若同一微孔中需同时进行发光和荧光实验,则应优先选择黑色微孔板。在白色微孔板中检测荧光,会因激发光反射导致信号极不稳定、背景信号极高,使荧光检测难以进行。在黑色微孔板中检测发光,虽会缩小检测窗口,但由于背景信号大幅降低、检测结果的偏差更小,仍能获得理想的检测结果。
信号串扰(Cross-Talk)指检测器非特异性地检测到 “非目标检测孔” 的发光信号,进而干扰 “实际检测孔” 信号的现象,这是仅影响发光检测的特有问题。
由于发光反应产生的光具有扩散性,它不仅会直接向上辐射,还可能扩散到邻近孔,并在检测其他孔时被检测器捕捉。这会导致信号偏差、变异度升高,整体灵敏度下降。根据反应类型和信号扩散特性,可通过多种方法解决这一问题:
对于仅持续几秒的闪光型实验,只需改变微孔板的检测顺序即可减少串扰。由于闪光信号衰减迅速,仅当相邻孔连续检测时,才会受到串扰影响;若检测顺序改为“先检测距离较远的孔,再检测相邻孔”,则因信号已衰减至无法检测的水平,串扰会大幅降低。为此,BMG LABTECH 酶标仪提供“交错读数模式(interlaced reading mode)”,该模式先检测每隔一个孔的信号,直至检测完整个微孔板,再返回检测未检测的孔。这种设计可确保先检测孔的信号在检测其相邻孔前已充分衰减。
辉光型实验的信号稳定且持续数小时,需采用其他策略消除串扰。干扰信号主要通过两种路径到达检测位点:一是从微孔板上方扩散,二是穿过微孔壁扩散(图 8)。针对这两种路径,需采取不同的解决方法:
“遮光孔罩(Apertures)” 可从物理方式阻挡 “从微孔上方扩散至检测器” 的干扰信号。遮光孔罩是一种黑色勺状配件,中央带有小孔,使用时需置于微孔板上方(图 8)。目标孔的信号可通过小孔到达检测器,而周围微孔的信号则被物理遮挡。BMG LABTECH 的多功能酶标仪(PHERAstar FSX、VANTAstar 和 CLARIOstar Plus)均配备了用于提升发光检测性能的遮光孔罩。

即使是白色微孔板,光也能穿过微孔的塑料壁扩散。微孔板类型对“穿壁串扰”影响显著。通常,高密度微孔板(如 1536 孔板)的壁更薄,因此穿壁的光泄漏量比低密度微孔板更多;其次,微孔形状也会影响串扰,方形孔因与相邻孔共用孔壁,穿过壁的串扰更高,而圆形孔不与相邻孔共用壁,串扰更低;此外,微孔板颜色也会影响穿过壁的串扰,颜色越深,串扰越低,灰色微孔板则在“减少串扰”与“反射信号”之间取得了平衡。
若无法通过优化微孔板类型减少串扰,可对采集到的数据进行数学校正。先确定信号向相邻孔的渗漏比例,再通过算法对数据进行校正。BMG LABTECH 的 PHERAstar FSX、VANTAstar 和 CLARIOstar Plus 酶标仪均具备 “自动检测串扰并校正” 的功能。
白色微孔板具有固有磷光特性,暴露于光线后,微孔板自身会发射光。这种自发发光信号会干扰检测数据,导致空白信号升高、检测窗口缩小。因此,建议在暗处准备微孔板,或在检测前将微孔板置于暗处约 15 分钟,待磷光衰减后再进行检测。
滤光片主要用于生物发光共振能量转移(BRET)检测。由于发光信号通常较弱,建议使用带宽为 80-100 纳米的宽频滤光片,更宽的带宽可使更多光通过滤光片到达检测器,从而提升检测灵敏度。
报告基因实验将 “基因调控序列” 与 “报告分子的基因信息” 结合,用于研究基因表达变化或调控区域自身的修饰。需将报告基因的基因信息导入细胞。若报告基因被激活,则会转录、翻译产生相应的酶。在底物存在的情况下,酶会催化底物转化并产生光,通过检测发光信号可反映调控序列的活性。
双荧光素酶报告基因实验(DLR™)在系统中加入了第二种报告基因。除与“目标调控序列”偶联的报告基因外,还引入了由“管家启动子(housekeeping promoter)”调控的第二种荧光素酶作为内参对照。使用 CLARIOstar 或 VANTAstar 酶标仪及其“发光扫描功能(luminescence scanning option)”,可筛选出匹配的荧光素酶组合,例如在单一多重荧光素酶实验中同时使用多达 6 种荧光素酶。
最常用的细胞活性实验基于萤火虫荧光素酶,其活性随 ATP 水平升高而增强,发光信号强度也随之升高。活细胞会产生 ATP,细胞裂解后释放的 ATP 为荧光素酶反应提供能量,因此发光信号强度与细胞数量及活性正相关。
除基于 ATP 的终点法细胞活性实验外,发光实验也可实时监测细胞活性。向细胞培养体系中加入“前体底物(pro-substrate)”和萤火虫荧光素酶,前体底物仅能被活细胞还原,随后被荧光素酶催化发生发光反应。通过实时监测发光信号,可反映细胞活性的动态变化。关于这类实验的更多信息,可参考《实时细胞健康实验:以更少操作获得更优数据》("Real-time cell health assays deliver better data with less effort")。
在药物研发中,细胞活性实验也常用于研究“蛋白水解靶向嵌合体(PROTACs)”和“分子胶(molecular glues)”介导的靶向蛋白降解,包括基于 “已知降解子(degrons)与连接酶(ligases)特异性相互作用” 的靶向蛋白降解研究。

细胞代谢涵盖分子转化的多个步骤,目前已有多种用于检测细胞代谢通路的实验采用发光技术。基础代谢研究聚焦于葡萄糖等主要营养物质的利用。例如,可通过“葡萄糖 - Glo 实验(glucose glo assay)”追踪葡萄糖消耗;也可通过检测葡萄糖的分解产物(乳酸)间接反映葡萄糖消耗,相关实验为“乳酸 - Glo 实验(lactate glo assay)”。这两种实验的性能验证可参考应用说明《基于细胞的实验中,葡萄糖实验与乳酸实验可精准监测细胞葡萄糖代谢》("Glucose assay and lactate assay allow to monitor cellular glucose metabolism precisely in a cell-based assay")。此外,应用说明《基于细胞的 Promega ROS-Glo™实验:发光法检测活性氧》("ROS detection in a cell-based format using the Promega ROS-Glo™ assay")展示了如何通过发光实验检测过量产生的活性氧(ROS)。
受体是常见的药物靶点,其配体可能成为潜在治疗药物。可基于生物发光共振能量转移(BRET)原理,通过细胞实验研究配体与受体的结合。将荧光素酶在受体的胞外区域表达,配体则标记上合适的受体荧光团。若配体与受体结合,供体(荧光素酶)与受体(荧光团)会达到足够近的距离,发生能量转移,BRET比值升高。
该方法还可用于研究未标记化合物与受体的结合。未标记化合物可与“已知荧光标记配体”竞争结合受体,在这种竞争性实验中,若 BRET比值降低,表明未标记化合物取代了受体荧光团,导致能量转移中断(图 9)。
关于这类实验如何助力受体药理学研究,可参考我们的学术讲座《受体药理学的实时分析》("Real-time profiling of receptor pharmacology")。

生物发光共振能量转移(BRET)原理也可用于研究两种蛋白质的相互作用。将其中一种相互作用蛋白与荧光素酶偶联,另一种与受体荧光团偶联。当两种蛋白质发生相互作用时,会引发能量转移,使荧光团发射光,BRET比值升高。该方法可用于研究 G 蛋白解离(G-protein dissociation)和 β- arrestin 募集(β-arrestin recruitment)。
此外,还可通过另一种基于发光的方法研究蛋白质相互作用。即应用说明《基于内源性 HiBiT CETSA 实验系统检测蛋白质 - 配体结合》("Measuring protein ligand binding with an endogenous HiBiT CETSA test system")中描述的“HiBiT CETSA 法”。该方法将“片段化的 HiBiT 纳米荧光素酶”与“目标蛋白(POI)”融合,可用于筛选“蛋白水解靶向嵌合体(PROTACs)”和“分子胶(molecular glues)”介导的靶向蛋白降解,也适用于研究“已知降解子(degrons)与连接酶(ligases)特异性相互作用”引发的靶向蛋白降解。在生理条件下,片段化的荧光素酶可组装形成具有功能的酶,产生发光信号。但加热会导致目标蛋白(POI)变性,阻止荧光素酶组装;若配体与目标蛋白结合,会提高目标蛋白的热稳定性,使其熔点发生可检测的偏移。
除蛋白质 - 蛋白质相互作用检测外,生物发光共振能量转移(BRET)原理还可用于生物传感器,实现生物分子的检测。例如,研究人员利用 CAMYEL BRET 生物传感器,探究了合成大麻素受体激动剂对 G 蛋白的差异激活作用。
基于微孔板的发光实验通常比基于其他原理的实验灵敏度更高。例如,发光酶联免疫吸附实验(ELISA)比比色法实验更灵敏,发光细胞活性实验比吸光度实验更灵敏。此外,发光检测技术可解决多种生物学问题,因其高灵敏度特性,适用于小体积样品的高通量应用。要实现发光检测,需配备与该技术灵敏度匹配的仪器。
对于非高通量应用,发光检测技术的优势在于“均相实验(homogenous assays)”的可用性。这类实验基于“加样 - 检测(add-and-measure)” 原理,操作简便、快速。此外,多种实时发光实验可在细胞过程发生时对其进行定量分析。
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows
Upgradeable single and multi-mode microplate reader series