
PHERAstar FSX
Powerful and most sensitive HTS plate reader


借助时间分辨荧光技术提升检测灵敏度,降低背景噪声,助力精准的免疫检测与相互作用研究。
荧光是分子在受到波长短于发射光的光激发后,发出的光。
荧光检测大致可分为两类测量方式:稳态荧光和时间分辨荧光。这两种方法的主要区别在于所用荧光分子(荧光团)的性质与特性,以及由此产生的检测时间差异。
稳态荧光是应用最广泛的荧光检测模式,通常被称为 “荧光强度” 检测。标准荧光团(如荧光素、罗丹明等)在被激发后,会在纳秒内发出特定波长的光。激发与发射之间的时间间隔极短,使得荧光发射信号的检测几乎能与样品的激发同步进行。
第二类是时间分辨荧光(TRF),它是在激发后随时间变化进行监测的。与稳态荧光强度检测不同,时间分辨荧光基于对强度衰减的检测,和 / 或在激发后延迟检测发射信号。在时间分辨荧光测量中,激发光脉冲的持续时间短于荧光信号的衰减时间。只有当荧光团的发射信号延长至微秒甚至毫秒级,而非像普通标记物那样在纳秒内快速衰减时,才能实现时间分辨荧光检测(图 1).
镧系元素(Ln)是一类具有独特荧光特性的金属化学元素,常被统称为 “稀土元素”。镧系元素的吸收(激发)系数极低,发射速率缓慢,这使得其荧光衰减时间延长至 0.5-3 毫秒(长寿命)。所有镧系元素均可形成三价阳离子(Ln³⁺),并在水溶液中能发出荧光。此外,它们的发射峰极为尖锐狭窄,且具有较大的斯托克斯位移。[1]
镧系元素具备作为生化探针的优良特性。最初,它们在生物体系中被用作钙的发光探针。事实上,镧系元素的发光特性已被证实可作为蛋白质中 Ca²⁺结合位点的灵敏传感器。[2]
其漫长的荧光衰减特性使其成为时间分辨荧光应用的理想荧光团。其中铕、铽、钐、镝四种元素在生命科学领域应用广泛,尤其在时间分辨荧光免疫检测中更为常见,而铕和铽的使用最为普遍(图 2)。
铕离子(Eu³⁺)尤其常被用作免疫检测中时间分辨荧光检测的标记物。除了具有长发射荧光寿命外,铕还具有 290 nm 的大斯托克斯位移,其激发光谱与发射光谱之间无重叠;此外,铕在 615 nm 处的发射光谱带宽仅为 10 nm,峰形极为尖锐(图 3)。[3]
由于镧系元素的发射信号通常过于微弱,无法满足时间分辨荧光应用的需求,因此它们一般不会被直接激发,而是嵌入一种聚光 “笼状结构” 中。这种笼状结构最常见的是螯合物或穴状化合物,它们既能实现能量收集,又能将能量转移给镧系离子,从而产生更强的发射强度(图 4)。值得一提的是,笼状结构 - 镧系元素复合物的激发光谱反映的是 “笼状结构” 的吸收光谱,而非镧系元素本身的吸收光谱。[4]
除了能增强发射信号外,螯合作用还能使镧系离子与生物分子(如抗体、受体、配体等)偶联,这是某些时间分辨荧光应用的必备条件。
与荧光强度检测类似,时间分辨荧光检测的装置由光源、用于波长选择的光学器件以及光电倍增管(PMT)检测器组成。
由于镧系元素 - 螯合物 / 穴状化合物复合物的典型激发波长为 337 nm,因此时间分辨荧光检测通常使用氙气闪光灯或特定激光器作为光源。多功能酶标仪配备了宽带氙气闪光灯,能为多种检测方法提供更高的灵活性。高端酶标仪还可配备专用的时间分辨荧光激发激光器。该激光器能将更多能量聚焦于镧系元素的特定激发波长,从而可能获得更优结果,更好地分辨低信号与高信号。然而,由于其激发波长集中在 337 nm 左右,这种激光器属于单一用途光源,除时间分辨荧光外,无法用作其他检测方法的激发光源。
在波长选择方面,基于滤光片和基于光栅的酶标仪均可用于时间分辨荧光检测。而基于滤光片的酶标仪透光率更高,通常比光栅酶标仪灵敏度更高,因此对于光子产率有限的时间分辨荧光(TRF)检测,推荐使用基于滤光片的酶标仪。通常而言,时间分辨荧光共振能量转移检测对基于光栅的酶标仪来说尤其具有挑战性。
使用光电倍增管(PMTs)作为检测器。由于镧系元素具有长发射寿命的特性,在时间分辨荧光检测中,光电倍增管检测器会在激发发生后才开启。这使得短寿命的自发荧光信号衰减消失。随后,发射信号的强度会在特定时间窗口内按时间函数进行积分。这两个参数分别被称为 “积分起始时间” 和 “积分时间”,通常在微秒范围内(图 5)。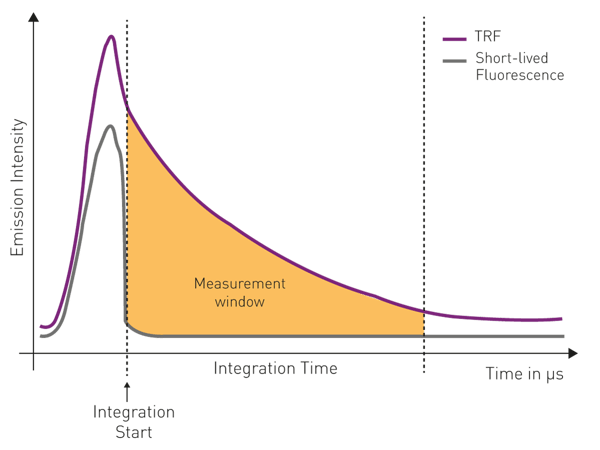
高端酶标仪还可配备用于时间分辨荧光检测的所谓光子计数光电倍增管(PMTs)。普通酶标仪在积分时间内仅能提供曲线下面积的积分值,而专用于时间分辨荧光的光子计数检测可以监测镧系元素的完整衰变曲线。
在 PHERAstar FSX 酶标仪上,光子计数检测能够以 2 微秒的时间分辨率进行检测并形成发射衰变曲线。这被称为 “衰变曲线监测”(Decay Curve Monitoring)的独特功能简化了时间分辨荧光检测方法的开发,有助于优化时间参数,从而改善信号检测效果并降低背景信号。
基于时间分辨荧光的免疫检测用于定量分析蛋白质、细胞因子等特定分子。该检测依赖于被荧光团标记的特异性抗体对靶标分子的识别与结合,通过对荧光信号的分析和定量,可间接获得靶标分子的相关信息。免疫检测具有定量性、高灵敏度的特点,并具备多参数检测(多重检测)的能力。
与经典的酶联免疫吸附试验(ELISA)类似,时间分辨荧光免疫检测通常使用结合在微孔板孔底的捕获抗体。将样品加入孔中孵育时,捕获抗体会将靶标分子捕获到板上。通过洗涤板去除未结合的样品后,加入与镧系螯合物(最常用的是铕)共价结合的第二抗体。该抗体与靶标分子结合,而未结合的第二抗体会被洗涤去除。镧系标记抗体的量与样品中靶标分子的浓度呈正比。时间分辨荧光免疫检测可采用直接检测或竞争检测模式进行。
由于以下三个原因,需要通过解离增强步骤将铕分子从抗体上的 “笼状结构” 中释放出来:第一,镧系元素的光吸收能力较弱;第二,它们很少被直接激发;第三,镧系螯合物与生物分子(此处为抗体)偶联后,荧光性会显著降低。解离过程通过加入一种常称为 “增强液” 的特定溶液来实现。该溶液除了能使镧系元素解离外,还能促进形成新的螯合 “笼状结构”,这种结构中包含镧系元素激发所需的发色团。增强液中的螯合剂 - 发色团可吸收激发光并将能量转移给镧系元素,从而显著增强发射信号的强度(图 6)。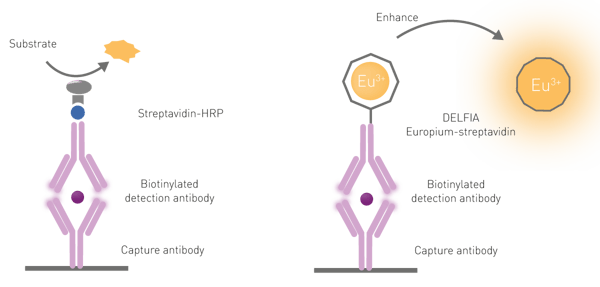
样品由特定波长(通常为 337 nm)的光脉冲激发。检测会根据自发荧光信号的衰减进行时间门控。这意味着,只有在短寿命的自发荧光信号(微秒级)完全衰减后,时间分辨荧光检测才会开始。检测到的发射信号会在特定时间窗口内进行积分,数据以积分强度(而非时间衰减)的形式被测量。由于分析物的量与时间分辨发射信号呈正比,因此借助标准曲线轻松对其进行定量。
DELFIA® 是最常用的时间分辨荧光免疫检测方法之一。
DELFIA(解离增强镧系荧光免疫检测法,Dissociation-Enhanced Lanthanide Fluorescent Immunoassay)是一种异相、包含洗涤步骤的时间分辨荧光检测方法,其原理和实验流程与酶联免疫吸附试验(ELISAs)相似。据称,该方法能克服酶联免疫吸附试验的典型局限性,具有更宽的动态范围,且产生的信号稳定性强,在检测完成后数月内仍可进行测量。进行 DELFIA 检测时,酶标仪需配备时间分辨荧光检测功能,激发波长为 337 nm,发射波长为 615 nm。
在 DELFIA 检测中,捕获抗体结合在微孔板上。加入样品并经过一系列洗涤步骤去除未结合的样品后,加入铕标记的检测抗体。最后,在完成最后一系列洗涤后,加入增强液。如前所述,DELFIA 检测需要通过解离增强步骤来产生荧光信号。这种解离过程会促使在稳定的胶束溶液中形成新的高荧光性螯合物。详情请查看《使用匹配抗体对试剂盒和 PHERAstar FSX 酶标仪在384 孔板进行时间分辨荧光(TRF)免疫检测》。
尽管 DELFIA 检测具有稳健性和极高的灵敏度,但由于其流程包含结合、孵育和洗涤步骤,因此不适合高通量筛选。
外泌体是来源于内泌体的细胞外囊泡,含有核酸、蛋白质和脂质。它们在生物体内不同细胞类型之间的细胞间通讯中发挥着重要作用。TRIFic™时间分辨荧光外泌体检测试剂盒基于特定膜蛋白的表达情况来检测外泌体的存在。
市面上有特定的对氧气和 pH 敏感的荧光探针,可用于在时间分辨荧光模式下分析细胞代谢参数。在特定的应用说明中,我们展示了如何在活细胞中实时测定细胞内和细胞外的氧气消耗以及糖酵解活性。
时间分辨荧光的另一项最广泛应用可能是在 TR-FRET(时间分辨荧光共振能量转移)技术中。该技术主要用于药物筛选和高通量筛选领域,因为时间分辨荧光共振能量转移检测具有稳健性,且易于自动化和微型化。其主要应用场景是蛋白质-蛋白质或配体-受体相互作用研究。
所有生物样品都会发出自发荧光,这通常是限制检测灵敏度的因素。由于自发荧光的衰减时间为纳秒级,因此在微秒或毫秒级进行时间分辨荧光测量(时间门控),可在自发荧光信号完全衰减后再检测镧系元素的发射信号。“短寿命” 荧光背景(背景信号和激发光散射)被消除,时间分辨荧光(长寿命)信号能够以极高的灵敏度被检测到,唯一的背景信号仅来自非特异性结合的标记物。与稳态荧光强度检测相比,这一特性降低了背景信号,提高了灵敏度。
激发波长最大值(峰)与发射波长最大值(峰)之间的差值被定义为斯托克斯位移。对于市面上许多稳态荧光团而言,其斯托克斯位移相对较窄,由于吸收光谱与发射光谱重叠,会导致信号自猝灭。相反,镧系元素具有较大的斯托克斯位移,这大大提高了时间分辨荧光检测中的信噪比(S/B)。
镧系元素具有较高的量子产率,其荧光强度高于 “常规” 荧光团。这一特性显著提升了时间分辨荧光检测的灵敏度。值得注意的是,高量子产率使镧系元素非常适合作为供体,但不适合作为受体。
据生产商介绍,如果时间分辨荧光免疫检测在解离 / 增强步骤前终止并妥善储存,其稳定性可长达 10 年。只需加入增强液,即可重新启动检测。
如上所述,螯合物通常将镧系元素嵌入 “笼状结构” 中,这种结构具有稳定镧系元素、将荧光团与分子结合或增强其荧光特性的功能。在时间分辨荧光检测中,这一最终步骤至关重要 —— 若镧系元素处于 “天然” 状态,其发射强度会非常微弱,而该步骤能提升发射强度。然而,不同类型笼状结构的转换存在明显局限性,因为这需要洗涤、加液等多个中间步骤。而基于荧光强度的检测通常无需这些步骤。
尽管时间分辨荧光检测具有更高的灵敏度和效率,但与基于荧光强度的检测方法相比,其试剂和仪器的投入成本更高。
时间分辨荧光检测通常需要从孔的顶部进行读数,且一般在白色微孔板中进行。由于延时检测可消除自发荧光并降低背景,白色微孔板具有显著优势 —— 它们能反射并增强发射光,从而产生更强的信号。若信号过强可能导致检测器饱和,则建议使用黑色微孔板。
对于基于细胞的时间分辨荧光检测,建议使用带有白色 / 黑色孔壁和透明孔底的微孔板,并从板底进行检测。但需注意,并非所有透明孔底都能透紫外光,部分塑料可能会吸收 340 nm 波长的光,进而显著减弱激发光(通常为 337 nm)。因此,在进行时间分辨荧光检测前,建议仔细查看微孔板的规格说明,选用具有紫外透光孔底的微孔板。更多细节可阅读《微孔板:实际应用中的实用性》。
如前所述,时间分辨检测可消除自发荧光。但在与镧系标记试剂孵育后、加入增强液前的洗涤步骤至关重要,可能会影响检测质量。这些步骤必须高效进行,才能去除所有未结合的标记试剂。若洗涤不彻底,未特异性结合的镧系离子会导致检测产生高背景信号。
在 DELFIA 检测中,应优先选用基于 TRIS-HCl 的缓冲液,而不是磷酸盐的缓冲液。一方面,高浓度的磷酸盐在长时间孵育过程中可能导致铕从其螯合物中解离;另一方面,与TRIS-HCl 的缓冲液相比,使用磷酸盐缓冲液通常会使最大信号值变低。
低 pH 值可能导致镧系离子从其螯合物中释放,这不仅会对染料的完整性产生不利影响,还会增加时间分辨荧光检测中的非特异性结合和背景信号。此外,需注意试剂中是否存在 EDTA,因为 EDTA 会使镧系螯合物失活。
由于镧系元素不产生偏振光发射,因此它们无法用于各向异性 / 荧光偏振测量。[5]
DELFIA 是珀金埃尔默公司的注册商标。
Powerful and most sensitive HTS plate reader
Most flexible Plate Reader for Assay Development
Flexible microplate reader with simplified workflows
Upgradeable single and multi-mode microplate reader series